Modelos Atómicos
 Modelo atómico de Dalton: El modelo permitió aclarar por primera vez por qué las sustancias químicas reaccionaban en proporciones estequimiométricas fijas ,
y por qué cuando dos sustancias reaccionan para formar dos o más
compuestos diferentes, entonces las proporciones de estas relaciones son
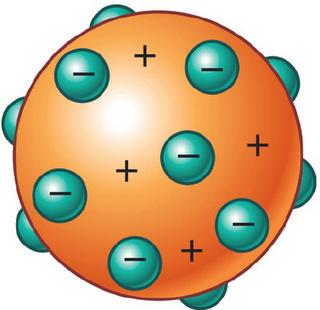
números MODELO ATÓMICO Modelo atómico de Thompson: el átomo está compuesto por electrones de carga negativa en un átomo positivo, distribuían uniformemente en el interior del átomo suspendidos en una
nube de carga positiva. El átomo se consideraba como una esfera con
carga positiva con electrones repartidos como pequeños gránulos. Modelo Thompson Modelo Rutherford:al átomo formado por dos partes: la "corteza", constituida por todos
sus electrones, girando a gran velocidad alrededor de un "núcleo" muy
pequeño; que concentra toda la carga eléctrica positiva y casi toda la
masa del átomo.
Rutherford llegó a la conclusión de que la masa del átomo se
concentraba en una región pequeña de cargas positivas que impedían el
paso de las partículas alfa . Modelo Rutherford
Modelo atómico de Dalton: El modelo permitió aclarar por primera vez por qué las sustancias químicas reaccionaban en proporciones estequimiométricas fijas ,
y por qué cuando dos sustancias reaccionan para formar dos o más
compuestos diferentes, entonces las proporciones de estas relaciones son
números MODELO ATÓMICO Modelo atómico de Thompson: el átomo está compuesto por electrones de carga negativa en un átomo positivo, distribuían uniformemente en el interior del átomo suspendidos en una
nube de carga positiva. El átomo se consideraba como una esfera con
carga positiva con electrones repartidos como pequeños gránulos. Modelo Thompson Modelo Rutherford:al átomo formado por dos partes: la "corteza", constituida por todos
sus electrones, girando a gran velocidad alrededor de un "núcleo" muy
pequeño; que concentra toda la carga eléctrica positiva y casi toda la
masa del átomo.
Rutherford llegó a la conclusión de que la masa del átomo se
concentraba en una región pequeña de cargas positivas que impedían el
paso de las partículas alfa . Modelo Rutherford




No hay comentarios:
Publicar un comentario